Nestes compostos, as unidades estruturais que os compõem são iões (positivos e negativos), normalmente de tamanhos diferentes, formando estruturas gigantes em que os iões se mantêm ligados através de atrações electrostáticas e também se encontram empacotados de modo a formar uma estrutura eletricamente neutra. Embora também ocorram repulsões entre iões com cargas elétricas do mesmo sinal, as posições assumidas pelos iões na estrutura cristalina permitem que as forças de atração se sobreponham às forças de repulsão.
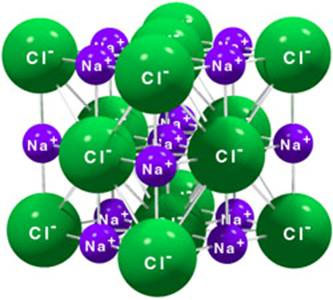
Um exemplo muito conhecido de um sólido iónico é o cloreto de sódio (fórmula química - NaCl) cuja estrutura cristalina se apresenta na figura ao lado. Este composto apresenta uma estrutura iónica, formada por iões positivos (Na+) e negativos (Cl-).
A ligação iónica é muito forte, conferindo a estes sólidos as propriedades referidas a seguir, no entanto, quando fundidos ou dissolvidos em água, tornam-se bons condutores elétricos, devido à mobilidade que apresentam os seus iões. Esta é uma característica que os distingue de todos os outros tipos de sólidos.
São duros.
São quebradiços.
Não se deformam (são por isso resistentes à deformação).
Apresentam pontos de fusão e de ebulição muito elevados.
São maus condutores de corrente elétrica, mas conduzem bem a corrente elétrica quando estão em solução aquosa (dissolvidos em água).
Manual Texto Editores - "Viver melhor na Terra".